SEL VOLTA
Sel Volta (sel galvani) memanfaatkan reaksi spontan (∆G < 0) untuk membangkitkan energi listrik, selisih energi reaktan (tinggi) dengan produk (rendah) diubah menjadi energi listrik. Sistem reaksi melakukan kerja terhadap lingkungan
Sel Elektrolisa memanfaatkan energi listrik untuk menjalankan reaksi non spontan (∆G > 0) lingkungan melakukan kerja terhadap sistem
Kedua tipe sel menggunakan elektroda, yaitu zat yang menghantarkan listrik antara sel dan lingkungan dan dicelupkan dalam elektrolit (campuran ion) yang terlibat dalam reaksi atau yang membawa muatan.
KOMPONEN SEL VOLTA
Rangkaian sel elektrokimia pertama kali dipelajari oleh LUIGI GALVANI (1780) danALESSANDRO VOLTA (1800). Sehingga disebut sel Galvani atau sel Volta. Keduanya menemukan adanya pembentukan energi dari reaksi kimia tersebut. Energi yang dihasilkan dari reaksi kimia sel Volta berupa energi listrik
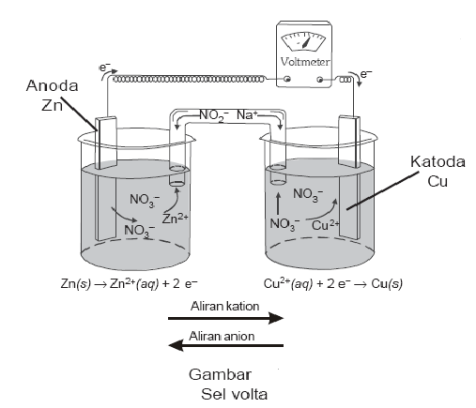
Sel Volta terdiri atas elektroda (logam seng dan tembaga) larutan elektrolit (ZnSO4 dan CuSO4), dan jembatan garam (agar-agar yang mengandung KCl). Logam seng dan tembaga bertindak sebagai elektroda. Keduanya dihubungkan melalui sebuah voltmeter. Elektroda tempat berlangsungnya oksidasi disebut Anoda (elektroda negatif), sedangkan elektroda tempat berlangsungnya reduksi disebut Katoda (elektroda positif)
ELEKTRODA
Elektroda terbagi menjadi dua jenis yaitu anoda dan katoda
Setengah reaksi oksidasi terjadi di anoda. Elektron diberikan oleh senyawa teroksidasi (zat pereduksi) dan meninggalkan sel melalui anoda
Setengah reaksi reduksi terjadi di katoda. Elektron diambil oleh senyawa tereduksi (zat pengoksidasi) dan masuk sel melalui katoda.
Setengah sel oksidasi: anoda berupa batang logam Zn dicelupkan dalam ZnSO4
Setengah sel reduksi: katoda berupa batang logam Cu dicelupkan dalam CuSO4
Terbentuk muatan relatif pada kedua elektroda dimana anoda bermuatan negatif dan katoda bermuatan positif
Kedua sel juga dihubungkan oleh jembatan garam yaitu tabung berbentuk U terbalik berisi pasta elektrolit yang tidak bereaksi dengan sel redoks gunanya untuk menyeimbangkan muatan ion (kation dan anion)
Dimungkinkan menggunakan elektroda inaktif yang tidak ikut bereaksi dalam sel volta ini misalnya grafit dan platinum.
NOTASI SEL VOLTA
•Sel Volta dinotasikan dengan cara yang telah disepakati (untuk sel Zn/Cu2+)
Zn(s)|Zn2+(aq)║Cu2+(aq)|Cu(s)
Bagian anoda (setengah sel oksidasi) dituliskan disebelah kiri bagian katoda
Garis lurus menunjukkan batas fasa yaitu adanya fasa yang berbeda (aqueous vs solid) jika fasanya sama maka digunakan tanda koma
Untuk elektroda yang tidak bereaksi ditulis dalam notasi diujung kiri dan ujung kanan.
POTENSIAL SEL
Sel volta menjadikan perubahan energi bebas reaksi spontan menjadi energi listrik
Energi listrik ini berbanding lurus dengan beda potensial antara kedua elektroda (voltase) atau disebut juga potensial sel (Esel) atau gaya electromotive (emf)
Untuk proses spontan Esel > 0, semakin positif Esel semakin banyak kerja yang bisa dilakukan oleh sel
Satuan yang dgunakan 1 V = 1 J/C
Potensial sel sangat dipengaruhi oleh suhu dan konsentrasi, oleh karena itu potensial sel standar diukur pada keadaan standar (298 K, 1 atm untuk gas, 1 M untuk larutan dan padatan murni untuk solid).
POTENSIAL SEL STANDAR
Potensial elektroda standar adalah potensial yang terkait dengan setengah reaksi yang ada (wadah elektroda)
Menurut kesepakatan potensial elektroda standar selalu ditulis dalam setengah reaksi reduksi
Bentuk teroksidasi + ne à bentuk tereduksi E 1/2 sel
Potensial elektroda standar seperti halnya besaran termodinamika dapat dibalik dengan mengubah tandanya
E sel = E katoda – E anoda
Ilmuwan telah menyepakati untuk memilih setengah reaksi rujukan dengan nilai 0 untuk reaksi:
2H+(aq, 1 M) + 2e à H2(g, 1 atm) Eorujukan = 0
H2(g, 1 atm) à 2H+(aq, 1 M) + 2e –Eorujukan = 0
Dengan nilai rujukan ini kita bisa menyusun sel volta yang menggunakan elektroda hidrogen standar sebagai salah satu elektrodanya dan mengukur potensial sel dengan alat ukur, kemudian kita dapat menentukan potensial elektroda standar banyak zat secara luas.
Semua nilai adalah relatif terhadap elektroda hidrogen standar (referensi)
2H+ (aq, 1 M) + 2e Û H2 (g, 1 atm)
Menurut konvensi semua setengah reaksi ditulis sebagai reaksi reduksi artinya semua reaktan pengoksidasi dan semua produk pereduksi
Nilai Eo yang diberikan adalah setengah reaksi tertulis, semakin positif nilainya semakin besar kecenderungan reaksi tersebut terjadi
Nilai Eo memiliki nilai yang sama tetapi berbeda tanda jika reaksinya kita balik
Berdasarkan tabel semakin keatas semakin oksidator dan semakin kebawah semakin reduktor.
REAKSI REDOKS SPONTAN
Setiap reaksi redoks adalah jumlah dari kedua setengah reaksi, sehingga akan ada reduktor dan oksidator ditiap-tiap sisi reaksi
Berdasarkan tabel maka reaksi spontan (Eosel> 0) akan terjadi antara oksidator (sisi reaktan) dan reduktor (sisi produk) yang terletak dibawahnya
Misal Cu2+ (kiri) dan Zn (kanan) bereaksi spontan dan Zn terletak dibawah Cu2+
Logam yang dapat menggantikan H2 dari asam. Ambil salah satu logam, tuliskan reaksi oksidasinya lalu jumlah untuk memperoleh Eosel jika positif maka H2 akan terlepas
Logam yang tidak dapat menggantikan H2, dengan langkah yang sama, namun jika hasilnya Eosel < 0, maka reaksi tidak spontan
Logam yang dapat menggantikan H2 dari air, logam yang terletak dibawah reduksi air
Logam yang dapat menggantikan logam lain dari larutannya, yaitu logam yang terletak dibagian bawah tabel dapat mereduksi logam yang terletak dibagian atas tabel.
Pengaruh Konsentrasi terhadap Potensial Sel
Sejauh ini potensial sel standar diukur dari potensial setengah sel juga pada keadaan standar sementara kebanyakan sel volta tidak beroperasi pada keadaan standarnya
Berdasarkan persamaan yang telah diketahui:
∆G = ∆Go + RT ln Q sedangkan
∆G = -nFEsel juga ∆Go = -nFEosel sehingga
-nFEsel = -nFEosel + RT ln Q
Esel = Eosel – (RT/nF) ln Q
Aplikasi Persamaan Nernst
Saat Q < 1 sehingga [reaktan] > [produk] maka Esel > Eosel
Saat Q = 1 sehingga [reaktan] = [produk] maka Esel = Eosel
Saat Q > 1 sehingga [reaktan] < [produk] maka Esel < Eosel
Jika kita memasukkan nilai R dan T pada 298
Esel = Eosel – (0,0592 V/n) log Q (pada 25oC)
Sumber : https://zhivinachem.wordpress.com/reaksi-redoks-dan-elektrokimia/
Tidak ada komentar:
Posting Komentar